據(jù)美國FDA官網公布結果,5月FDA新藥審批速度依舊給力,5月陸續(xù)批準了6款新藥����,這也是2020年至今批準新藥多的一個月份�。2020年未過半載�����,F(xiàn)DA已經批準22款新藥�����,預計全年獲批的新藥數(shù)量有望超過2019年�����。
圖1:2000年至今FDA批準的新藥數(shù)量

5月FDA批準的6款新藥�����,全為新分子實體���,也涉及多個疾病領域�����。Tabrecta是FDA批準的首款針對METex14突變轉移性NSCLC的靶向療法�����?����?芍委?種瘤種的Retevmo是首款被FDA批準用于治療攜帶RET基因改變的癌癥藥物�。Qinlock是首款被FDA批準用于四線治療胃腸道間質瘤的靶向藥物���。Artesunate是目前美國少有一款批準用于治療嚴重瘧疾的藥物����。還有兩款放射性診斷劑Cerianna�、Tauvid,分別為乳腺癌的臨床篩查和阿爾茨海默病評估提供重要幫助�����。
表1:FDA批準新藥的詳細信息
MET靶點重磅藥物:
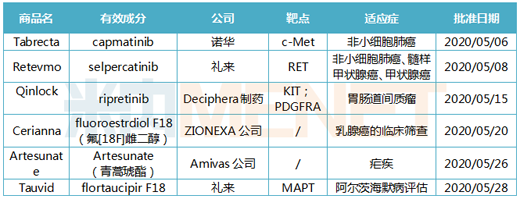
Tabrecta(capmatinib)
2020年5月6日��,諾華宣布FDA加速批準Tabrecta(Capmatinib) 上市,用于治療局部晚期或轉移性MET外顯子14跳躍(METEX 14)突變的非小細胞肺癌(NSCLC)患者�。Tabrecta是FDA批準的首款、全球第二款針對METex14突變轉移性NSCLC的靶向療法�。此前,Tabrecta獲得了FDA授予的突破性療法認定和孤兒藥資格����,其新藥申請也獲得了優(yōu)先審評資格。
肺癌無論發(fā)生率還是死亡率�,在全球范圍內都“名列前茅”,而非小細胞肺癌是常見的肺癌類型����,約占所有肺癌病例的85%-90%。MET是癌癥的驅動基因之一����,在非小細胞肺癌中,帶有MET突變的病例約占總數(shù)的3-4%���。優(yōu)異的臨床試驗數(shù)據(jù)為Tabrecta獲批奠定堅實的基礎����。
數(shù)據(jù)表明�����,無論患者先前是否曾接受過治療,Tabrecta均能帶來顯著治療效果�。在初治的患者中,Tabrecta的總緩解率為68%����;在經治的患者中���,Tabrecta的總緩解率為41%。兩組患者的中位緩解持續(xù)時間分別是11.14個月和9.72個月��。
Tabrecta的活性成分capmatinib是一款口服MET抑制劑,可通過阻斷MET基因的變異表達�,從而有助于阻止腫瘤細胞的生長�。目前����,MET靶點被認為是癌癥領域一顆冉冉升起的新星�,國內多家藥企已針對MET靶向藥進行布局及開發(fā)。
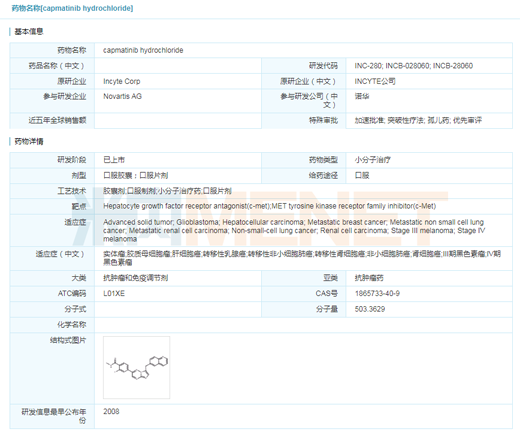
表2:國內MET靶向藥研發(fā)進展(不完全統(tǒng)計)
多瘤種新藥:
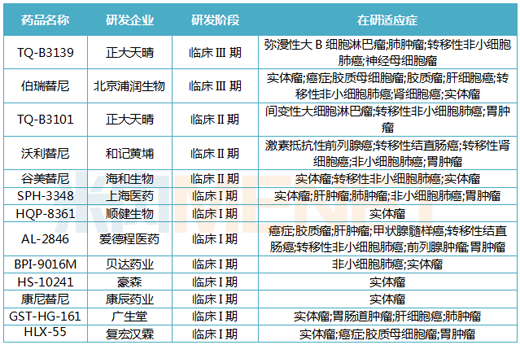
Retevmo(selpercatinib)
2020年5月8日��,F(xiàn)DA正式批準禮來子公司Loxo Oncology開發(fā)的Retevmo(selpercatinib),用于治療3種癌癥的患者����,包括:治療轉移性RET融合陽性非小細胞肺(NSCLC)�����、晚期或轉移性RET突變甲狀腺髓樣癌(MTC)和晚期或轉移性RET融合陽性甲狀腺癌�����。
Retevmo是首款被FDA批準用于治療攜帶RET基因改變的癌癥藥物。此前���,Retevmo已獲得FDA授予的孤兒藥����、突破性藥物、優(yōu)先審查等資格�����。
此次批準主要基于名為LIBRETTO-001的單臂多中心I/II期臨床試驗數(shù)據(jù)。該臨床試驗既納入了初治患者��,也納入了經治的各種晚期實體腫瘤患者��,通過客觀緩解率(ORR)和中位緩解持續(xù)時間(DOR)兩個終點指標評估Retevmo治療存在RET基因改變的患者的療效�。
表3:Retevmo臨床試驗數(shù)據(jù)
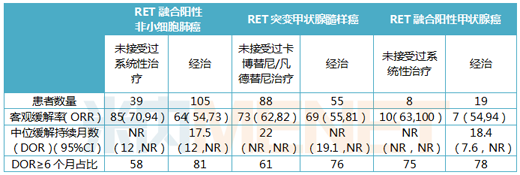
(注:NR為未達到)
Retevmo關于治療非小細胞肺癌方面�����,105例經治患者的ORR為64%����,81%的患者DOR≥6個月�����,39例初治的患者中����,ORR為84%�����;在治療甲狀腺髓樣癌方面,55例經治患者的ORR為69%��,76%的應答患者DOR≥6個月,88例初治患者中��,ORR為73%,61%的患者DOR≥6個月��;在治療RET融合陽性的甲狀腺癌方面��,19例接受過另一種系統(tǒng)療法的甲狀腺癌患者ORR為79%,87%的應答患者DOR≥6個月����;8例未治的甲狀腺癌患者中��,ORR為100%,75%的應答患者DOR≥6個月���。
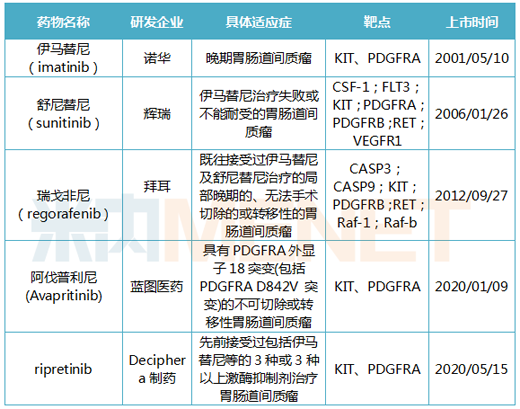
GIST首款四線治療:
Qinlock(ripretinib)
2020年5月15日����,再鼎醫(yī)藥合作伙伴Deciphera的Qinlock(ripretinib)獲得FDA批準上市�,用于晚期胃腸道間質瘤(GIST)四線治療。該藥是首款被FDA批準用于四線治療胃腸道間質瘤的靶向藥物���。Qinlock適用于先前接受過包括伊馬替尼(imatinib)����、舒尼替尼(sunitinib)���、瑞戈非尼(regorafenib)在內的3種或3種以上激酶抑制劑治療的成人患者��。Qinlock的獲批比目標行動日期提前了3個月����,并曾獲得FDA授予的突破性藥物、孤兒藥�、快速通道���、優(yōu)先審查等資格��。目前,該藥也在中國申報臨床試驗�。
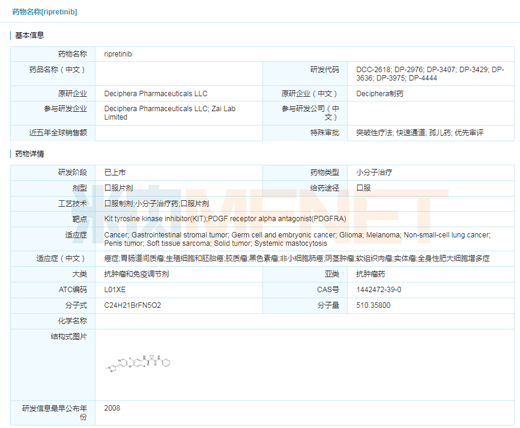
胃腸道間質瘤是一種罕見的間葉源性腫瘤��,其主要病因80%-90%是KIT基因突變��,5%-10%是PDGFRA基因突變��,導致酪氨激酶活化�����,細胞生長失控并發(fā)生癌變�。在此之前��,F(xiàn)DA共批準4種針對胃腸道間質瘤患者的靶向藥物��,但部分患者進行以上治療后無反應�,腫瘤繼續(xù)發(fā)展,這種情況下Qinlock可以給患者帶來新的希望�。
Qinlock的有效性和安全性在名為INVICTUS的III期臨床試驗數(shù)據(jù)中得到驗證。數(shù)據(jù)表明����,接受Qinlock治療的患者的中位無進展生存期(PFS)達到6.3個月��,比對照組多出5.3個月����。Qinlock將患者疾病進展或死亡風險降低85%��,且Qinlock組患者中位總生存期為15.1個月����,顯著優(yōu)于對照組(6.6個月)��,將患者死亡風險降低64%���。
表4:FDA批準胃腸道間質瘤靶向藥
放射性診斷劑:
Cerianna(fluoroestrdiol F18)
2020年5月20日,F(xiàn)DA批準Zionexa公司的放射性診斷劑Cerianna(fluoroestrdiol F18)上市���,作為活檢的輔助手段與正電子發(fā)射斷層掃描(PET)成像共用��,檢測雌激素受體(ER)陽性的復發(fā)或轉移性乳腺癌患者。PET造影劑Cerianna的獲批���,為乳腺癌的臨床篩查提供又一選擇。
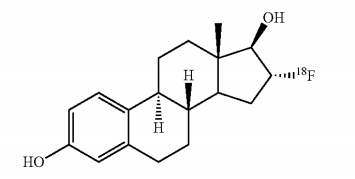
fluoroestrdiol F18化學結構式
CERIANNA是一種無菌、澄清��、無色的靜脈注射溶液���,其活性成分氟雌二醇F18(fluoroestrdiol F18)是一種合成的雌激素類似物���。一項納入了90名經組織學證實為浸潤性乳腺癌的女性的臨床試驗數(shù)據(jù)為此次批準提供支持�。數(shù)據(jù)結果通過評分方式得出結果,在47例活檢陽性患者中�,有36例影像學檢查陽性;在38例活檢陰性患者中�,所有38例影像學均為陰性;11例影像學檢查假陰性的患者中����,有10例活檢陽性�����。
青蒿琥酯抗瘧:
Artesunate(Artesunate)
2020年5月26日��,F(xiàn)DA宣布批準Amivas公司的青蒿琥酯(Artesunate)靜脈注射劑用于治療患有嚴重瘧疾的成人和兒童����。青蒿琥酯是目前美國少有一款批準用于治療嚴重瘧疾的藥物�。此前,青蒿琥酯靜脈注射劑還獲得了FDA授予的孤兒藥資格認定�,新藥申請也獲得了優(yōu)先審評資格��。
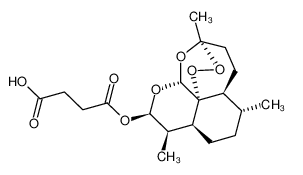
Artesunate化學結構式
瘧疾是一種由蚊子叮咬傳播的寄生蟲病,其流行程度和危險性一點都不亞于癌癥等其他重大疾病�����。這是因為瘧疾一旦變得嚴重�,就會影響到中樞神經系統(tǒng)。據(jù)WHO估計��,2018年�,全球瘧疾病例數(shù)超過2.2億���,約造成40.5萬人死亡�。
青蒿琥酯靜脈注射治療嚴重瘧疾的安全性和有效性在兩項臨床試驗中得到評估�。亞洲進行的一項隨機對照試驗以及在非洲開展的一項支持性隨機對照試驗中�����,使用青蒿琥酯治療的患者在院內死亡的人數(shù)均明顯低于使用奎寧治療的對照組患者�。
阿爾茨海默病tau病理成像藥:
Tauvid(flortaucipir F18)
2020年5月28日�����,禮來公司的放射性診斷劑Tauvid(flortaucipir F18)正式被FDA批準�,用于大腦的正電子發(fā)射斷層掃描(PET)成像��,以評估腦中聚集的tau神經原纖維纏結(NFT)的密度和分布����。Tauvid通過判斷阿爾茨海默?。ˋD)的主要標志物之一——tau神經原纖維纏結���,以幫助需要接受AD評估的認知障礙成人患者��。這也是首款被FDA批準幫助對大腦中的tau病理進行成像的藥物����。

阿爾茨海默病是一種起病隱匿的進行性發(fā)展的神經系統(tǒng)退行性疾病,目前沒有徹底治愈的藥物��,使用診斷成像可以幫助患者及其家人更好的規(guī)劃未來�。
此次批準主要基于兩項臨床研究的數(shù)據(jù)�。一項研究,獨立病理學家對患者Tauvid腦掃描成像及患者死后大腦組織中NFTs的密度和分布進行了評估���。兩者之間的比較顯示����,解讀Tauvid圖像的評估者有較高幾率正確判斷存在tau病理的患者�,評估無tau病理患者的準確率為中等到高��。
第二項研究檢測Tauvid評估者的解讀與其他評估結果之間的一致性����。解讀完全吻合的一致性為1��,而完全不吻合的一致性為0����。在這一研究中�����,對所有241例患者的解讀一致性為0.87��。亞組分析表明����,82例終末期疾病患者的一致性為0.82�,159名認知功能障礙患者的一致性為0.90���。
資料來源:FDA官網����、企業(yè)公告��、米內網數(shù)據(jù)庫
聲明:本文版權歸原作者所有����,轉載文章僅為傳播更多信息��,如作者信息標記有誤���,或侵犯您的版權,請聯(lián)系我們���,我們將在及時修改或刪除內容��,聯(lián)系郵箱:marketing@360worldcare.com










