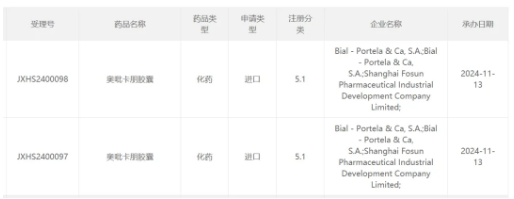
今日(11月14日)��,中國國家藥監(jiān)局藥品審評中心(CDE)官網(wǎng)新公示���,復(fù)星醫(yī)藥和Bial-Portela & Ca公司共同申報的5.1類新藥奧吡卡朋膠囊的上市申請獲得受理。公開資料顯示�,這是復(fù)星醫(yī)藥引進(jìn)的治療原發(fā)性帕金森病的新藥Opicapone膠囊,為新一代的兒茶酚-氧位-甲基轉(zhuǎn)移酶抑制劑(COMT)抑制劑�。
截圖來源:CDE官網(wǎng)
帕金森?����。≒D)是中老年常見的神經(jīng)系統(tǒng)退行性疾病���,治療方法主要包括藥物治療�����、手術(shù)治療����、運(yùn)動康復(fù)療法等。左旋多巴是目前治療帕金森病的主要藥物�。但當(dāng)疾病進(jìn)入中晚期,患者單用左旋多巴會面臨療效衰減等問題���。奧吡卡朋膠囊作為COMT抑制劑����,作為聯(lián)合用藥添加進(jìn)治療方案中��,可以抑制左旋多巴的分解����,使其更多的進(jìn)入大腦,從而提高治療效果���,改善癥狀�����。
公開資料顯示�,奧吡卡朋自2016年在歐盟首次獲批上市,作為左旋多巴/多巴脫羧酶抑制劑(DDCIs)制劑的輔助療法����,用于帕金森病和劑量末運(yùn)動波動不能穩(wěn)定的成年帕金森病患者。
2020年�,奧吡卡朋獲美國FDA批準(zhǔn)上市,作為左旋多巴/卡比多巴的輔助療法�����,治療經(jīng)歷“關(guān)閉”期(“off” episodes)的帕金森病患者����。隨著疾病的進(jìn)展,服用左旋多巴/卡比多巴的患者可能開始出現(xiàn)“關(guān)閉”期�,在此期間患者的震顫、運(yùn)動減慢和行走困難的發(fā)生率會增加��。
在中國���,奧吡卡朋尚未獲得NMPA批準(zhǔn)上市�,但該產(chǎn)品已經(jīng)于今年3月獲批在樂城先行區(qū)博鰲超級醫(yī)院首次使用���。復(fù)星醫(yī)藥成員企業(yè)萬邦醫(yī)藥曾于2018年與葡萄牙Bial - Portela & Ca公司達(dá)成協(xié)議��,萬邦醫(yī)藥將在中國大陸地區(qū)獨(dú)家銷售代理奧吡卡朋�����。根據(jù)協(xié)議�����,萬邦醫(yī)藥將向Bial公司支付250萬歐元的首付款�����,并另外支付總額不超過1250萬歐元的里程碑付款�。
根據(jù)FDA批準(zhǔn)時的相關(guān)新聞稿�����,奧吡卡朋的獲批是基于38項(xiàng)臨床研究數(shù)據(jù)的支持�,其中包括2項(xiàng)3期臨床研究(BIPARK-1和BIPARK-2)���,有超過1000名帕金森病患者接受該產(chǎn)品的治療。兩項(xiàng)研究均包括1年開放標(biāo)簽擴(kuò)展期����。試驗(yàn)數(shù)據(jù)顯示,與安慰劑相比�����,50mg奧吡卡朋顯著縮短了較基線時的“關(guān)閉”期時間�,且患者運(yùn)動能力正常的“開啟”期時間也顯著增長。另外�,在臨床用藥中,相比于第二代COMT抑制劑須一日多次使用�����,奧吡卡朋對COMT的抑制作用顯著且持久�����,一天口服一次即可實(shí)現(xiàn)持續(xù)抑制�。
截圖來源:中國藥物臨床試驗(yàn)登記與信息公示平臺官網(wǎng)
根據(jù)中國藥物臨床試驗(yàn)登記與信息公示平臺官網(wǎng)公示,由Bial-Portela & Ca和復(fù)星醫(yī)藥共同開展的奧吡卡朋膠囊在中國的3期臨床試驗(yàn)已經(jīng)完成�,針對適應(yīng)癥為:作為左旋多巴/多巴脫羧酶抑制劑(左旋多巴/芐絲肼或左旋多巴/卡比多巴)的聯(lián)合治療用藥�,用于治療以上藥物不能控制的成人帕金森病及劑末現(xiàn)象(癥狀波動)��。
本次這款奧吡卡朋膠囊在中國申報上市�����,意味著它有望在不久的將來惠及更多患者�。
聲明:本文版權(quán)歸原作者所有����,轉(zhuǎn)載文章僅為傳播更多信息,如作者信息標(biāo)記有誤�,或侵犯您的版權(quán),請聯(lián)系我們���,我們將在及時修改或刪除內(nèi)容��,聯(lián)系郵箱:marketing@360worldcare.com