阿斯利康三抗癌癥1類新藥在中國獲批臨床
今日(10月29日)���,中國國家藥監(jiān)局藥品審評中心(CDE)官網(wǎng)公示,阿斯利康(AstraZeneca)的AZD5492在中國獲批臨床���,擬用于治療復(fù)發(fā)性或難治性B細(xì)胞惡性腫瘤。公開資料顯示���,這是一款CD20×TCR×CD8三特異性抗體���,是由CD8引導(dǎo)的T細(xì)胞銜接器劑���。此次是這款候選新藥在中國獲批臨床。
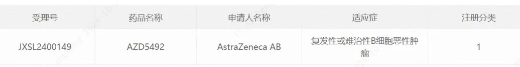
截圖來源:CDE官網(wǎng)
B細(xì)胞惡性腫瘤是一類起源于B淋巴細(xì)胞的惡性疾病���。B淋巴細(xì)胞是免疫系統(tǒng)中的關(guān)鍵組成部分���,負(fù)責(zé)產(chǎn)生抗體以對抗外來病原體���。當(dāng)B細(xì)胞發(fā)生異常增殖和不受控制的分化時,便可能形成B細(xì)胞惡性腫瘤���,如多發(fā)性骨髓瘤���、淋巴瘤等。
AZD5492是一種不對稱的三特異性單克隆IgG1抗體���,它含有兩個抗CD20的Fab結(jié)構(gòu)域���、一個與TCR 結(jié)合的VHH結(jié)構(gòu)域���,以及一個與CD8共受體結(jié)合的VHH結(jié)構(gòu)域���。公開資料顯示���,由于抗CD20抗體對B細(xì)胞的特異性作用,其被廣泛開發(fā)應(yīng)用于B細(xì)胞相關(guān)疾病的治療���,包括B細(xì)胞淋巴瘤等.
AZD5492結(jié)構(gòu)式(截圖來源:參考資料2)
在今年6月份召開的2024歐洲血液學(xué)協(xié)會(EHA)年會 上���,一項AZD5492用于治療B型非霍奇金淋巴瘤的臨床前研究數(shù)據(jù)被公布���。這項臨床前研究在體外和體內(nèi)探索了AZD5492的作用機制���,并與傳統(tǒng)CD3xCD20 T細(xì)胞銜接器劑的生物活性做了比較。
該研究表明���,與傳統(tǒng)的CD20xCD3 T細(xì)胞銜接器劑(相當(dāng)于接合和激活CD4+和CD8+T細(xì)胞)相比���,AZD5492通過優(yōu)先連接CD8+T細(xì)胞來誘導(dǎo)一定程度的B細(xì)胞殺傷,同時減少CD4+T細(xì)胞的活化和相關(guān)的細(xì)胞因子產(chǎn)生���。AZD5492在B細(xì)胞淋巴瘤治療方面有望顯著提高治療效果���,為臨床進一步評估這款候選藥物提供了強有力的生物學(xué)依據(jù)。
在全球領(lǐng)域���,根據(jù)ClinicalTrials.gov官網(wǎng)信息,阿斯利康已經(jīng)登記了一項1/2期臨床研究���,旨在評估AZD5492在復(fù)發(fā)/難治性B細(xì)胞惡性腫瘤患者中的安全性、PK���、PD和有效性���。該研究擬在美國、澳大利亞等19個中心開展���,計劃入組174名受試者���,預(yù)計將于2028年2月結(jié)束。
此次AZD5492在中國獲批臨床���,意味著這款在研新藥即將在中國開展臨床研究���。
聲明:本文版權(quán)歸原作者所有���,轉(zhuǎn)載文章僅為傳播更多信息���,如作者信息標(biāo)記有誤,或侵犯您的版權(quán)���,請聯(lián)系我們���,我們將在及時修改或刪除內(nèi)容,聯(lián)系郵箱:marketing@360worldcare.com

