浙江大學王青青團隊發(fā)文:發(fā)現(xiàn)抑制肝癌進展新策略
8月13日,浙江大學王青青研究團隊在期刊《Advanced Science》上發(fā)表了研究論文�����,題為“Berberine Protects against Hepatocellular Carcinoma Progression by Regulating Intrahepatic T Cell Heterogeneity”���,本研究中����,研究人員建立了原位肝癌小鼠模型,并使用不同劑量的BBR進行治療����。BBR可有效降低肝癌小鼠的腫瘤負荷�����。流式細胞術檢測顯示BBR治療后腫瘤免疫格局的變化���,揭示了T淋巴細胞效應功能的增強�����。其中���,BBR降低了TCRbhiPD-1hiCD69+CD27+效應性CD8+ T淋巴細胞的比例,升高了Ly6ChiTCRb+CD69+CD27+CD62L+中央記憶性CD8+ T淋巴細胞的比例����。單細胞RNA測序進一步闡明了BBR對肝臟免疫細胞轉錄譜的影響�����,并證實了肝癌免疫微環(huán)境中T淋巴細胞的表型異質性�����。此外�,BBR可能通過調節(jié)細胞因子介導的免疫細胞之間的受體-配體相互作用來調節(jié)肝癌中的抗腫瘤免疫��。綜上所述�,這些發(fā)現(xiàn)提高了對BBR在預防HCC方面的作用的理解,強調了BBR在調節(jié)肝內T細胞異質性方面的作用���。BBR有望成為一種抑制肝癌進展的治療策略���。
背景知識
肝癌是癌癥相關死亡的第三大原因,其中肝細胞癌(HCC)是常見的原發(fā)性肝癌類型����。在過去的十年中,包括免疫檢查點抑制劑(ICIs)�、酪氨酸激酶抑制劑和單克隆抗體在內的全身治療已經改變了HCC的傳統(tǒng)治療模式。據估計,單藥ICIs為15-20%的應答者提供了實質性的臨床益處���,但面臨生物標志物無法識別這一人群的挑戰(zhàn)���。因此,有必要探索新的治療策略來改善HCC的治療前景�。
肝臟免疫微環(huán)境在肝癌的發(fā)生過程中起著至關重要的作用。例如�����,觀察到浸潤腫瘤的T細胞和B細胞相互作用�,導致局部免疫激活和對肝癌進展的控制�����。一項使用單細胞RNA測序(scRNA-seq)的研究揭示���,在肝癌微環(huán)境中����,耗竭的CD8+T細胞和浸潤的Treg細胞可能發(fā)生克隆擴增��。與在原發(fā)性肝癌中觀察到的典型的耗竭狀態(tài)不同,早期復發(fā)肝癌中的CD8+T細胞表現(xiàn)出類似于固有免疫的降低的細胞毒性和克隆擴增��,這可能解釋了與肝癌相關的受損抗腫瘤免疫功能和不良預后�����。因此�����,調節(jié)腫瘤免疫微環(huán)境(TIME)可能有助于開發(fā)有效的肝癌治療方法�。
黃連素(BBR)是一種從黃連、黃柏等植物的根����、樹皮和根莖中提取的異喹啉生物堿,具有多種藥理作用�。之前的研究表明,BBR通過減少糖異生和脂質合成來緩解非酒精性脂肪性肝病���。此外�����,BBR還被報道通過激活PPARδ觸發(fā)細胞凋亡并促進腸道微生物產生的丁酸來抑制肝癌�����。近年來����,研究人員越來越關注BBR的免疫調節(jié)特性。研究人員發(fā)現(xiàn)�����,BBR通過降低PD-L1表達和增強腫瘤浸潤T細胞的免疫功能來抑制非小細胞肺癌���。另一項研究表明�,BBR促進免疫抑制性M2巨噬細胞向腫瘤殺傷性M1巨噬細胞轉化���,恢復T細胞的抗腫瘤細胞毒性。然而���,BBR調節(jié)肝癌免疫反應的確切機制尚未被發(fā)現(xiàn)�。
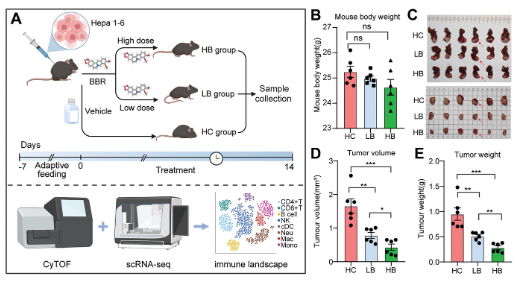
BBR治療減輕肝癌小鼠的腫瘤負荷
為了研究BBR治療HCC的潛力���,研究人員建立了原位HCC小鼠模型����。在適應性喂養(yǎng)一周后,將Hepa 1-6細胞注射到小鼠左葉肝臟中����,然后給予小鼠腹腔內BBR注射。根據BBR劑量�����,將小鼠分為三組:HC組(對照組)��、LB組(低劑量BBR�����,10 mg/kg)和HB組(高劑量BBR�����,30 mg/kg)��。每兩天給予BBR一次����,共14天�。在處死小鼠后�,收集小鼠肝臟并切除腫瘤組織進行進一步分析。結果顯示�,三組小鼠體重差異無統(tǒng)計學意義。然而�,接受BBR治療的小鼠腫瘤體積明顯減小。特別是與LB組相比�����,高劑量BBR治療顯示出更顯著的腫瘤體積和重量減少(p<0.05)���,表明BBR在減輕小鼠HCC負擔方面呈劑量依賴性趨勢���。綜上所述,BBR在小鼠模型中顯示出減少腫瘤負荷的功效���,提示其可能具有預防HCC進展的功能。
BBR治療能減少HCC小鼠體內的腫瘤負荷
BBR增強肝癌免疫細胞間的相互作用與通訊
CellChat被用來確定各種免疫細胞類型之間的配體-受體相互作用和通信網絡�。與HC組相比,研究人員觀察到高劑量BBR治療后整體細胞間相互作用的增加����。配體-受體分析揭示��,高劑量BBR主要通過趨化因子配體-受體對(如CCL3-CCR5�、CCL5-CCR5��、CXCL16-CXCR6)以及SPP1-(ITGA+ITGB)配體/受體對(如SPP1-(ITGA4+ITGB1)����、SPP1-(ITGAV+ITGB1))調節(jié)肝臟免疫細胞向CD4+T細胞的信號轉導。此外�����,BBR主要通過包括CCL5-CCR1�����、CCL5-CCR5���、巨噬細胞遷移抑制因子(MIF)-(CD74+CD44)���、LGALS9-CD44、LGALS9-CD45�、LGALS9-HAVCR2和SPP1-(ITGA+ITGB)在內的配體/受體對介導CD4+T細胞與免疫細胞如MoMF和庫普弗細胞之間的細胞間通信。
此外����,高劑量BBR通過CCL3-CCR5��、CCL5-CCR5�、CXCL6-CXCR6和SPP1-(ITGA4+ITGB1)等配體-受體對調節(jié)肝癌免疫細胞與CD8+T細胞之間的相互作用���。BBR主要通過CCL5-CCR1����、CCL5-CCR5和SPP1-(ITGA+ITGB)等配體-受體對促進CD8+T細胞與其他免疫細胞之間的通信��。此外�����,高劑量BBR治療還可在CD8+T細胞中誘導特定的信號���,包括TGFβ���、IL1和GDF。綜上所述�����,高劑量BBR的抗肝癌作用可能是通過調節(jié)由細胞因子和趨化因子介導的免疫細胞之間的配體-受體相互作用���,從而調節(jié)肝臟免疫微環(huán)境實現(xiàn)的���。
研究小結
總之,本研究結果表明�,BBR通過調節(jié)肝內T淋巴細胞的異質性來阻止HCC的發(fā)展,具體來說就是增加中央記憶CD8+T細胞的比例�����,同時減少效應CD8+T細胞的比例�����,從而逆轉T細胞耗竭���。此外��,BBR還可通過調節(jié)T淋巴細胞分泌的細胞因子以及影響其分化狀態(tài)來抑制HCC����。本研究為BBR在HCC中的免疫調節(jié)機制提供了新的見解���,表明其在HCC管理方面具有潛在的應用前景�。
聲明:本文版權歸原作者所有,轉載文章僅為傳播更多信息��,如作者信息標記有誤�,或侵犯您的版權,請聯(lián)系我們�,我們將在及時修改或刪除內容,聯(lián)系郵箱:marketing@360worldcare.com