寧波大學研究學者發(fā)現(xiàn)“癌王”胰腺癌靶向治療方案
3月16日���,寧波大學研究學者在期刊《Cell Death & Disease》上在線發(fā)表題為“HMGA2 alleviates ferroptosis by promoting GPX4 expression in pancreatic cancer cells”的研究論文,本研究闡明了HMGA2通過抑制鐵死亡來增強胰腺癌細胞死亡抵抗力的機制���。這是通過激活mTOR信號通路和隨之而來的GPX4水平增加實現(xiàn)的�����。這些發(fā)現(xiàn)為未來克服胰腺癌化療耐藥性的治療方法提供了潛在的靶點�。
研究背景
胰腺癌是惡性較強的腫瘤類型之一���,也是兩性癌癥相關死亡的第四大原因�。胰腺癌通常未被發(fā)現(xiàn)�����,進展迅速�,直到晚期并擴散,因此難以及時診斷�����。胰腺癌的臨床治療可分為手術�、化療和放療三部分。由于胰腺癌的高放射耐藥性�,以及鄰近器官無法耐受高劑量的輻射,因此治愈胰腺癌的唯一方法是完全切除和全身化療相結合���。然而�����,近期的研究表明�����,胰腺癌具有異質性細胞組成和冷腫瘤微環(huán)境���,導致對新輔助化療和/或放療的耐藥性�。
研究發(fā)現(xiàn)
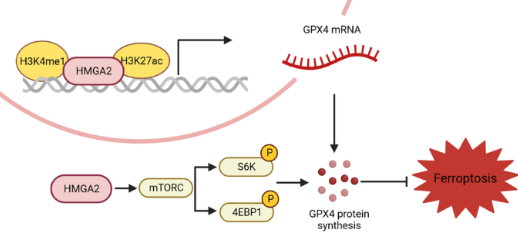
在本研究中�����,研究人員證明了HMGA2在胰腺癌組織中高度表達���,主要分布在上皮細胞中���,并且代表了高上皮-間充質轉化的亞型。HMGA2 的缺失通過細胞增殖���、轉移和體內異種移植腫瘤生長來抑制腫瘤惡性�����。此外���,HMGA2通過抑制活性氧和促進谷胱甘肽的產生來增強細胞氧化還原狀態(tài)���。過表達HMGA2的細胞中鐵死亡得到顯著改善。相反�����,HMGA2缺失加劇了鐵死亡���。
機制上,HMGA2通過轉錄和翻譯調控激活GPX4表達���。HMGA2通過增加H3K4甲基化和H3K27乙?;瘉碓鰪娫鰪娮踊钚?����,從而結合并促進GPX4基因啟動子區(qū)域的順式元件修飾�。此外,HMGA2通過mTORC1-4EBP1和-S6K信號軸刺激GPX4蛋白合成。HMGA2的過表達緩解了mTORC1藥理學抑制導致的GPX4蛋白水平下降�����。相反�,與對照組相比,HMGA2缺失更強烈地降低了4EBP1和S6K的磷酸化�����。使用免疫組織化學染色證實了HMGA2和GPX4表達之間的強正相關���。研究人員還證明�����,HMGA2減輕了癌細胞對鐵死亡誘導劑和mTORC1抑制劑或吉西他濱聯(lián)合治療的敏感性�。研究結果揭示了HMGA2協(xié)調GPX4表達的調控機制�,并強調了靶向HMGA2在癌癥治療中的潛在價值。
研究結論
綜上所述���,本研究闡明了HMGA2通過抑制鐵死亡來增強胰腺癌細胞死亡抵抗力的機制���。這是通過激活mTOR信號通路和隨之而來的GPX4水平增加實現(xiàn)的�����。這些發(fā)現(xiàn)為未來克服胰腺癌化療耐藥性的治療方法提供了潛在的靶點�。
聲明:本文版權歸原作者所有�����,轉載文章僅為傳播更多信息�,如作者信息標記有誤,或侵犯您的版權�����,請聯(lián)系我們�,我們將在及時修改或刪除內容�����,聯(lián)系郵箱:marketing@360worldcare.com