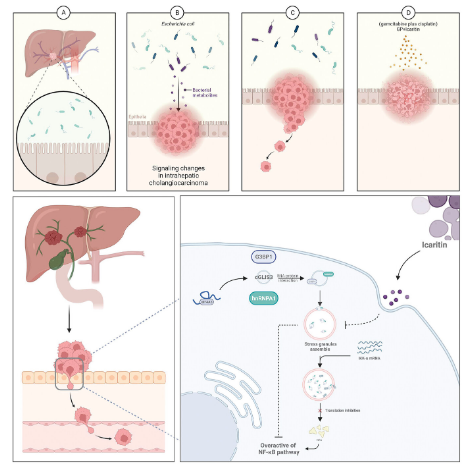
近日,福建醫(yī)科大學研究人員在期刊《Advanced Science》上發(fā)表了研究論文,題為“Escherichia coli-Induced cGLIS3-Mediated Stress Granules Activate the NF-κB Pathway to Promote Intrahepatic Cholangiocarcinoma Progression”��。研究人員通過構建體外和體內ICC模型和患者源性類器官(PDOs),表明大腸桿菌誘導一種新的RNA cirglis3 (cGLIS3)的產生���,促進腫瘤生長��。研究還表明���,伊卡蒿素(ICA)和吉西他濱聯合順鉑(GP)化療可能是一種很有前景的治療ICC的策略。
研究背景
肝內膽管癌(ICC)累及膽管二級分支,預后較差��。它是第二常見的膽道惡性腫瘤���,占原發(fā)性肝癌的10-15%��。近年來,全球范圍內ICC的發(fā)病率顯著上升�����。然而���,其發(fā)生和發(fā)展的機制尚不完全清楚�����。
先前的研究表明���,肝膽管結石病(在肝臟內形成的結石)是ICC的高危因素,尤其是在中國�����。并發(fā)ICC和肝內膽管病的患者通常預后較差。雖然肝內膽管結石曾被認為是ICC的主要原因���,但近期的研究表明��,細菌在肝內膽管結石的形成和ICC的進展中起著重要作用���。細菌通過與宿主膽汁組織相互作用促進肝內膽管病的發(fā)生,從而導致肝內膽管病誘導的膽汁淤積�����、細菌增殖和炎癥反應�����。這些事件促進了ICC的進展�����。臨床資料表明��,ICC和肝內膽管結石患者經常表現出膽道微生物群的不平衡���,包括大腸桿菌��,可能促進ICC細胞的惡性行為���。雖然之前的研究已經證實了大腸桿菌的致癌作用��,很少有研究調查大腸桿菌的致癌行為�����。
研究進展
研究人員發(fā)現SG的形成常通過凝聚特定的靶蛋白或mrna引起細胞內信號通路之間的交互作用��。例如�����,circVAMP通過應激顆粒(SGs)抑制c-Myc翻譯從而抑制原癌基因Myc蛋白的表達。大腸桿菌刺激的ICC細胞出現NF-κB通路的異常激活��,在包括ICC在內的惡性腫瘤的轉移和耐藥中發(fā)揮重要的調控作用���。cglis介導的SGs引起NF-κB通路的持續(xù)激活���。SGs阻斷了IKKα mRNA的表達。這將引起NF-κB通路信號的持續(xù)激活���,從而促進ICC的侵襲���、遷移和化療耐藥�����。這一機制不同于以往對NF-κB通路的調控機制�����,揭示了大腸桿菌刺激ICC細胞中NF-κB通路活化和腫瘤進展的新途徑�����。
先前的研究表明�����,大腸桿菌可能需要細胞因子來促進癌癥���。本研究結果表明,在大腸桿菌感染期間��,IL6的上調尤其異常���。根據研究結果���,當加入抗IL6時��,大腸桿菌干預導致的SGs組裝增加和ICC的惡性行為在一定程度上得到了恢復���。研究人員選擇ICA作為一種具有雙重作用(抑制IL - 6和NF-κB)的新藥,可以顯著抑制大腸桿菌刺激的ICC細胞中SGs的產生��。本研究首次為ICC伴肝膽管結石病的發(fā)展提供了新的視角���,并為SGs在腫瘤中的作用提供了新的理論基礎��。
ICA靶向Ecoli-cGLIS3軸抑制SGs形成的示意圖
研究結論
綜上��,大腸桿菌通過上調剪接因子eIF4A3的表達,促進SGs的組裝��,導致NF-κB通路的持續(xù)激活���,從而增強ICC的惡性程度��。cGLIS3表達上調代表了ICC的一個有前景的診斷和治療靶點���,并為circRNA調控在癌癥中的功能重要性增加了一個新的維度�����。本研究為ICC的治療提供了新的機制和治療策略���。
聲明:本文版權歸原作者所有,轉載文章僅為傳播更多信息�����,如作者信息標記有誤���,或侵犯您的版權���,請聯系我們,我們將在及時修改或刪除內容��,聯系郵箱:marketing@360worldcare.com