廈門大學發(fā)現血管病靶向治療新策略
1月17日,廈門大學研究團隊在期刊《Cell Death Discovery》上發(fā)表了題為“NMDARs activation regulates endothelial ferroptosis via the PP2A-AMPK-HMGB1 axis”的研究論文,本文中�,研究人員證明了NMDAR通過PP2A-AMPK-HMGB1途徑調控鐵死亡在內皮細胞損傷中的新作用。
研究背景
血管內皮細胞(VECs)位于富氧的血管環(huán)境中����,通過調節(jié)血管舒張、收縮�、生長抑制和生長促進的平衡以及抗炎或促炎作用,對支持血管的結構和生物功能�、維持血管張力至關重要。VEC功能障礙可能導致動脈硬化和血栓閉塞性脈管炎等心血管疾病���,這些疾病與心血管危險因素密切相關���。與動脈硬化不同,內皮功能障礙也可以逆轉���。因此���,應早期預防和治療,以預防血管疾病。鐵死亡是一種新型的調控細胞死亡�,于2012年被首次報道。它是一種鐵依賴的脂質過氧化反應�,在生化上與其他形式的細胞死亡,如壞死�、凋亡和焦亡不同。研究發(fā)現�,細胞鐵死亡的增加進一步加劇了許多疾病的功能損傷,如缺血性疾病����、腫瘤和組織損傷,包括創(chuàng)傷性腦損傷����、神經退行性疾病、葉酸誘導的腎損傷和CAD���。然而����,在NMDAR激活條件下���,鐵死亡在內皮細胞功能和血管功能障礙中的作用尚未被探討���。
研究發(fā)現
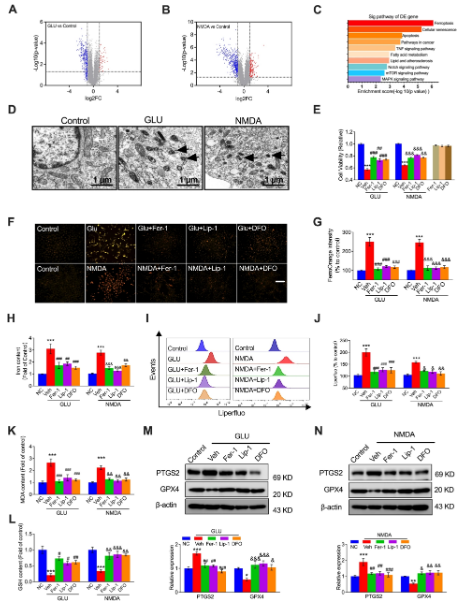
在本研究中,研究人員發(fā)現L-谷氨酸(GLU)或NMDA激活NMDAR通過增加鐵含量�、MDA和PTGS2的表達來促進鐵死亡,并降低GPX4的表達���,這被鐵死亡抑制劑Fer-1���、Lip-1或DFO逆轉。PP2A-AMPK-HMGB1通路是與NMDAR激活誘導的鐵死亡相關的主要通路����,這通過PP2A抑制劑LB-100、AMPK激活劑AICAR或HMGB1 siRNA得到驗證����。NMDAR在鐵死亡中的作用通過鐵死亡激活劑Erastin或RSL3得到驗證,這被NMDAR抑制劑MK-801抵消���。體內實驗結果顯示�,MK-801����、LB-100、AICAR、MK-801和GLY逆轉了NMDA或GLU誘導的鐵死亡����,證實了PP2A-AMPK-HMGB1通路參與了NMDAR激活誘導的血管內皮鐵死亡。本研究證明了NMDAR通過PP2A-AMPK-HMGB1通路調節(jié)鐵死亡在內皮細胞損傷中的作用�。
鐵死亡參與NMDAR激活介導的血管內皮細胞損傷
另外,已有報道指出���,PP2A/AMPK通路參與了鐵死亡���。AMPK調節(jié)代謝、線粒體穩(wěn)態(tài)和自噬���。當葡萄糖缺失時�,它被激活����,開啟了針對鐵死亡的能量應激保護程序,涉及多不飽和脂肪酸的生物合成受損����,這對于脂質過氧化驅動的鐵死亡至關重要。本研究通過PP2A/AMPK/HMGB1通路激活NMDAR�,發(fā)現了AMPK在鐵死亡中的一個新作用���。研究人員證明,在NMDAR激活后����,通過去磷酸化PP2Ac上的Tyr307位點來激活PP2A����,并進一步去磷酸化AMPK以增加HMGB1表達誘導HUVECs的鐵死亡。
研究結論
鐵死亡是血管內皮細胞死亡的一種表現形式����,其發(fā)生機制與血管內皮細胞死亡有關,但具體機制不同���,AMPK信號通路在一定程度上介導了鐵死亡過程�。本研究證實NMDA和GLU激活PP2A���,抑制AMPK���,進而促進HMGB1,介導鐵死亡����。本研究探討了NMDAR激活誘導血管內皮細胞鐵死亡的機制�,并對部分結論進行了體內驗證����,旨在為血管內皮細胞死亡的治療提供新的視角,為開發(fā)新的抗血管內皮鐵死亡藥物提供具體的理論基礎和思路���。
聲明:本文版權歸原作者所有���,轉載文章僅為傳播更多信息,如作者信息標記有誤���,或侵犯您的版權����,請聯(lián)系我們�,我們將在及時修改或刪除內容,聯(lián)系郵箱:marketing@360worldcare.com