合源生物CAR-T產(chǎn)品「納基奧侖賽」在中國獲批,治療白血?���?�!
今日(11月8日)�,中國國家藥監(jiān)局(NMPA)官網(wǎng)公示��,合源生物遞交的CAR-T產(chǎn)品納基奧侖賽注射液(曾用名:赫基侖賽)的上市申請已獲得批準����,用于治療成人復發(fā)或難治性B細胞急性淋巴細胞白血病(r/r B-ALL)��。值得一提的是���,這也是一款在中國獲批上市的治療白血病的CAR-T產(chǎn)品����。
截圖來源:NMPA官網(wǎng)
白血病是常見的血液腫瘤之一��,急性淋巴細胞白血?。ˋLL)約占所有白血病的15%,其中B淋巴細胞型-ALL(B-ALL)約占ALL的75%��。成人B-ALL患者較兒童B-ALL患者整體生存更差�。成人B-ALL初治后復發(fā)率高,約60%的患者終會進展到r/r B-ALL。成人r/r B-ALL患者預后極差��,嚴重危及生命��,臨床缺乏有效治療手段����。
納基奧侖賽注射液(CNCT19細胞注射液,Inaticabtagene Autoleucel)是一款靶向CD19的CAR-T細胞治療產(chǎn)品�����,擁有創(chuàng)新的CD19 scFv(HI19a)結(jié)構(gòu)����。該藥已在中國獲批多項臨床試驗,針對的適應癥包括:用于治療成人復發(fā)或難治性ALL��、治療復發(fā)或難治性侵襲性B細胞非霍奇金淋巴瘤和治療兒童和青少年復發(fā)或難治B細胞型ALL�。其中,該藥針對復發(fā)或難治性ALL的申請還被NMPA納入突破性治療品種�����。
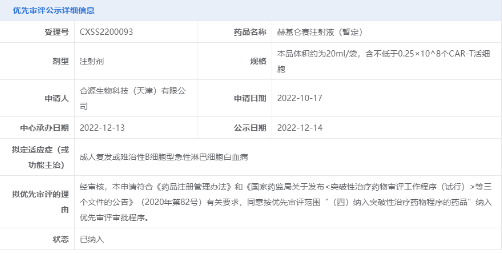
2022年12月�,中國國家藥品監(jiān)督管理局藥品審評中心(CDE)正式受理了納基奧侖賽注射液治療成人復發(fā)或難治性B細胞型急性淋巴細胞白血病的新藥上市申請�����,并將其納入優(yōu)先審評,這也是該藥本次獲批的適應癥�。
截圖來源:CDE官網(wǎng)
納基奧侖賽的上市申請是基于一項用于治療成人復發(fā)或難治性B細胞型急性淋巴細胞白血病的單臂、開放��、多中心關(guān)鍵性臨床研究��。該研究由中國醫(yī)學科學院血液病醫(yī)院(中國醫(yī)學科學院血液學研究所)王建祥教授擔任主要研究者���,在中國10家臨床中心開展�����。主要研究終點為經(jīng)獨立評審委員會(IRC)評估的納基奧侖賽回輸后3個月時的總體緩解率(ORR)�,包括完全緩解(CR)和血細胞不完全恢復的完全緩解(CRi)���。次要研究終點包括3個月內(nèi)總體緩解率(ORR)����、微小殘留病陰性率(MRD-)�����、緩解持續(xù)時間(DOR)、無復發(fā)生存期(RFS)和總生存期(OS)�。
在2022年12月進行的第64屆美國血液學年會(ASH)上,研究人員以大會口頭報告的形式發(fā)布了這一關(guān)鍵性臨床研究數(shù)據(jù)��。截至2022年9月27日����,39例成人r/r B-ALL患者接受了納基奧侖賽注射液回輸。具體試驗數(shù)據(jù)如下�。
患者顯示了持久的高緩解率:總體緩解率(ORR)達82.1%,中位隨訪9.3個月時����,中位緩解持續(xù)時間(DOR)尚未達到;在3個月時仍緩解的患者中����,1年時預計有80%患者在持續(xù)緩解中;無論是否后續(xù)接受造血干細胞移植�����,均能表現(xiàn)出持續(xù)緩解和長期生存獲益�。
顯著降低的CAR-T治療相關(guān)毒性嚴重性:3級及以上細胞因子風暴(CRS)發(fā)生率為10.3%�;3級及以上免疫效應細胞相關(guān)神經(jīng)毒性綜合征(ICANS)發(fā)生率為7.7%����,無非預期靶向CD19 CAR-T治療導致的不良事件發(fā)生。
值得一提的是�,今年3月�,美國FDA也已批準納基奧侖賽注射液的IND申請,擬開發(fā)用于治療成人復發(fā)或難治性B細胞型急性淋巴細胞白血?���。˙-ALL)。希望納基奧侖賽注射液的其它臨床研究也順利進行�����,早日惠及更多患者�����。
聲明:本文版權(quán)歸原作者所有�,轉(zhuǎn)載文章僅為傳播更多信息,如作者信息標記有誤�����,或侵犯您的版權(quán),請聯(lián)系我們��,我們將在及時修改或刪除內(nèi)容��,聯(lián)系郵箱:marketing@360worldcare.com