新型mRNA疫苗�����!曾木圣團隊發(fā)文:揭示EBV相關惡性腫瘤治療新策略
10月27日�����,中山大學曾木圣研究團隊在期刊《ADVANCED SCIENCE》上在線發(fā)表題為“mRNA-based Vaccines Targeting the T-cell Epitope-rich Domain of Epstein Barr Virus Latent Proteins Elicit Robust Anti-Tumor Immunity in Mice”的研究論文,研究結果表明�����,本研究開發(fā)的基于mRNA的EBV治療疫苗為治療EBV相關惡性腫瘤提供了一種有前景的新策略�����。然而�����,還需要進一步研究來評估它們在臨床試驗中的安全性和療效�����,并優(yōu)化其設計以增強其治療潛力�����。
研究背景
EBV是人類一個被鑒定為致癌病毒的病毒�����,已感染全球超過90%的人口�����。EBV主要感染上皮細胞和B細胞�����,約占人類惡性腫瘤的約2%�����。EBV的持續(xù)存在是由于其能夠在宿主細胞中建立潛伏感染并逃避免疫識別的能力�����。通常�����,EBV感染發(fā)生在兒童期�����,并且通常沒有癥狀�����。隨后�����,EBV可以在宿主細胞中建立潛伏感染并逃避免疫識別�����,通?����?梢猿掷m(xù)宿主的一生。
EBNA1在EBV相關腫瘤中持續(xù)表達�����,并且對于維持和復制EBV基因組至關重要�����,而EBNA3A在EBV誘導的淋巴瘤中上調表達�����,并且可以在體外誘導出強效的抗EBV特異性細胞毒性T淋巴細胞(CTLs)�����。此外�����,與健康人的對照淋巴細胞相比�����,EBV誘導的淋巴瘤細胞的LMP2A�����、EBNA1和EBNA3A的mRNA水平分別增加了38倍�����、1157倍和1154倍�����。因此,這些EBV潛伏蛋白是有希望用于治療疫苗的候選物�����。
基于mRNA的疫苗由于其能夠誘導安全�����、有效和持久的免疫反應,近期已經成為癌癥疫苗開發(fā)的一種有前途的技術�����。這些疫苗可以有效地引發(fā)細胞和體液免疫反應�����,并且它們不會產生顯著的抗載體免疫力�����,這使得可以進行重復的接種�����。此外,mRNA疫苗不含有DNA�����,消除了基因組整合的風險�����。它們的良好安全性得以證明�����,因為在冠狀病毒疾病的mRNA疫苗中觀察到�����,它們無法整合到宿主基因組中或重新激活潛伏病毒�����。此外�����,mRNA可以在體內直接表達�����,這使得它成為難以在體外純化的抗原的有吸引力的替代品。
研究發(fā)現(xiàn)
本研究開發(fā)并測試了三種mRNA疫苗�����,分別編碼EBV潛在蛋白的T細胞表位豐富區(qū)域�����,包括Trunc-LMP2A�����、Trunc-EBNA1和Trunc-EBNA3A�����。這些疫苗在小鼠中有效激活細胞和體液免疫�����,并在抑制腫瘤進展和改善攜帶腫瘤小鼠的生存時間方面顯示出有希望的結果�����。此外�����,觀察到截斷形式的抗原Trunc-LMP2A�����、Trunc-EBNA1和Trunc-EBNA3A比全長抗原更有效地激活特異性抗原免疫反應�����。綜上所述�����,研究結果表明基于mRNA的治療性疫苗對EBV潛伏蛋白的T細胞表位豐富區(qū)域具有有效性�����,并為EBV相關癌癥提供了新的治療選擇�����。
Trunc-LMP2A-RNP在攜帶
腫瘤的小鼠中提供了更優(yōu)越的保護
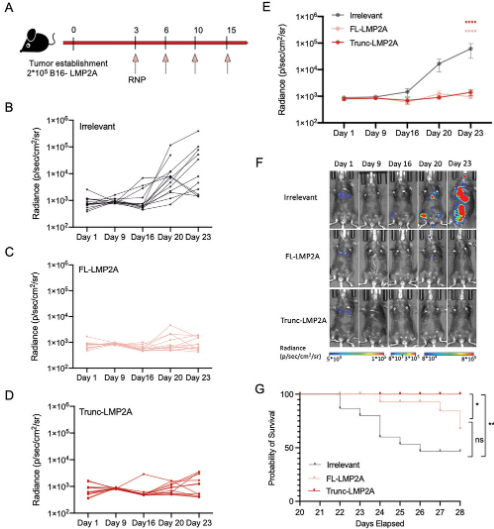
我們進一步研究了Trunc-LMP2A-RNP的抗腫瘤效果是否與更強的T細胞免疫相關�����。首先,我們將2×105表達全長LMP2A的B16細胞接種到C57BL/6小鼠體內�����,然后通過靜脈注射給予RNP疫苗�����。根據第23天的生物發(fā)光信號�����,與無關對照組相比�����,Trunc-LMP2A-RNP和FL-LMP2A-RNP在抑制腫瘤進展方面表現(xiàn)出類似的效果�����。然而�����,接受Trunc-LMP2A-RNP處理的小鼠的存活時間顯著長于接受FL-LMP2A-RNP處理的小鼠�����。這表明Trunc-LMP2A-RNP在攜帶腫瘤的小鼠中提供了比FL-LMP2A-RNP更好的保護�����。
此外�����,我們使用皮下腫瘤模型�����,在BALB/c小鼠體內皮下接種過表達LMP2A的1×105 4T1細胞�����。Trunc-LMP2A-RNP和FL-LMP2A-RNP對腫瘤進展的抑制作用明顯強于無關-RNP組�����。在第28天�����,無關-RNP組中約85%的小鼠死亡。而FL-LMP2A-RNP組有一只小鼠在第28天死亡�����,而Trunc-LMP2A-RNP組沒發(fā)生死亡�����。
研究結果
綜上所述�����,本研究開發(fā)的基于mRNA的EBV治療疫苗為治療EBV相關惡性腫瘤提供了一種有前景的新策略�����。然而�����,還需要進一步研究來評估它們在臨床試驗中的安全性和療效�����,并優(yōu)化其設計以增強其治療潛力�����。
聲明:本文版權歸原作者所有�����,轉載文章僅為傳播更多信息�����,如作者信息標記有誤�����,或侵犯您的版權�����,請聯(lián)系我們�����,我們將在及時修改或刪除內容�����,聯(lián)系郵箱:marketing@360worldcare.com