阿爾茨海默氏原纖維的清晰圖像顯示了以前未知的細節(jié)
來自德國和荷蘭的一組研究人員已經(jīng)確定了以前無法實現(xiàn)的淀粉樣蛋白原纖維的結構����。人體自身的淀粉樣蛋白(Aβ)的原纖維是阿爾茨海默氏癥相關疾病和腦中特征性病理蛋白沉積的主要成分����。
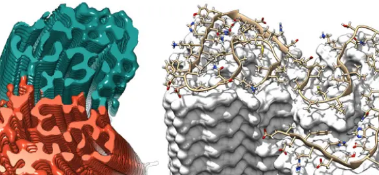
來自ForschungszentrumJülich,杜塞爾多夫海因里希海涅大學����,漢堡結構系統(tǒng)生物學中心和馬斯特里赫特大學的科學家闡明了原子級的三維結構�,該結構顯示了以前未知的結構細節(jié),可以回答有關有害沉積物生長的許多問題����,并且解釋遺傳風險因素的影響��。研究結果已發(fā)表在知名的《科學》雜志上�。
該結構揭示了許多單個Aβ蛋白分子如何相互交錯排列��,并排列成所謂的原絲�。這些原絲中的兩個彼此纏繞在一起形成原纖維��。如果這些原纖維中的幾根被纏結��,那么這會引起在阿爾茨海默氏病患者腦組織中檢測到的典型沉積或斑塊�。
杜塞爾多夫海因里希海涅大學物理生物學研究所所長,復雜系統(tǒng)研究所(ICS)所長Dieter Willbold教授解釋說:“這是對淀粉樣蛋白結構及相關疾病有基本了解的里程碑����?���!?-6)ForschungszentrumJülich?���!霸w維結構回答了許多有關原纖維生長機理的問題����,并確定了一系列導致早老性早老性癡呆的家族性突變所起的作用?�!?Willbold說��。
該小組獲得的4埃分辨率(相當于0.4納米)在典型的原子半徑和原子鍵長范圍內(nèi)�。與以前的工作相反��,該模型首次顯示了蛋白質的確切位置和相互作用。纏結的原絲的Aβ分子不是處于同一水平����,而是像拉鏈一樣將它們錯開半個間隔�。此外,該結構首次闡明了許多單個Aβ蛋白分子的所有42個氨基酸殘基的位置和構象�。
這種新穎而詳細的結構為理解許多遺傳修飾的結構效果提供了新的基礎����,這些遺傳修飾會增加患該病的風險。它們可以通過在定義的位置改變蛋白質的藍圖來穩(wěn)定原纖維(現(xiàn)在可以看到)��。例如����,這也解釋了為什么在自然界中小鼠不會發(fā)展為阿爾茨海默氏癥�,以及為什么一小部分冰島人似乎對該病具有或多或少的抵抗力。它們的Aβ變體分別相差三個或一個氨基酸殘基�,這顯然對原纖維的穩(wěn)定性很重要����。
較高技術水平上的方法多樣性
與100多年前Alois Alzheimer發(fā)現(xiàn)的典型疾病斑塊相反,現(xiàn)在發(fā)現(xiàn)的原纖維結構無法在光學顯微鏡下直接觀察到��。經(jīng)過一年多的時間����,科學家分析了使用馬斯特里赫特大學的低溫電子顯微鏡設備獲得的數(shù)據(jù)����。此外,使用固態(tài)核磁共振(NMR)光譜和X射線衍射實驗進行的測量有助于補充和完全支持原纖維結構的圖像��,并驗證所獲得的數(shù)據(jù)�。
聲明:本文版權歸原作者所有�,轉載文章僅為傳播更多信息,如作者信息標記有誤��,或侵犯您的版權����,請聯(lián)系我們����,我們將在及時修改或刪除內(nèi)容����,聯(lián)系郵箱:marketing@360worldcare.com
