7月6日�,F(xiàn)DA官網顯示衛(wèi)材/渤健聯(lián)合開發(fā)的lecanemab(商品名:Leqembi)用于治療阿爾茨海默癥(AD)的加速批準已成功轉為完全批準�。這也意味著lecanemab成為了20年來一款獲得FDA完全批準的AD新療法。
Lecanemab是一種抗β淀粉樣蛋白(Aβ)單克隆抗體�,可以選擇性中和并清除導致阿爾茨海默病神經病變的可溶且有毒性的Aβ聚集體。因此,lecanemab可能對AD病理過程產生積極影響并減緩疾病發(fā)展進程�。衛(wèi)材和渤健共同負責該產品的開發(fā)和商業(yè)化,且衛(wèi)材擁有終決策權�。
1月6日,基于IIb期概念驗證性臨床試驗 (BAN2401-G000-201) 結果�,F(xiàn)DA在加速審批途徑下批準了lecanemab治療AD的上市申請。不過�,只有在輕度認知障礙或輕度癡呆階段且在病理學上確認存在Aβ的AD患者中才能進行l(wèi)ecanemab治療。
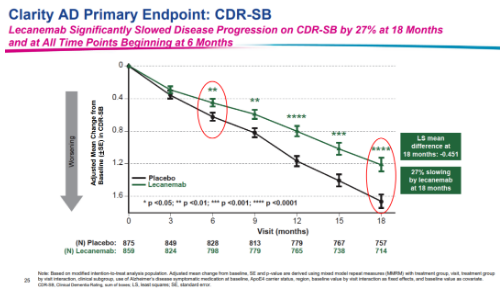
在lecanemab獲得加速批準的同一天�,衛(wèi)材向FDA提交了尋求lecanemab全面批準的sBLA。此次申請是基于驗證性III期Clarity AD研究的積極結果�,試驗達到了主要終點和所有關鍵次要終點,且結果具有高度統(tǒng)計學意義�。
6月10日,在FDA外周和中樞神經系統(tǒng)藥物咨詢委員會上�,與會專家以6:0的投票結果一致支持lecanemab基于III期CLARITY AD研究的積極結果獲得完全批準。
目前�,lecanemab的定價為2.65萬美元/年。美國醫(yī)保方(CMS)曾表態(tài)在lecanemab全面批準時可能會考慮擴大覆蓋范圍�。
值得一提的是,lecanemab在中國的上市申請已于2022年12月獲CDE受理�。
聲明:本文版權歸原作者所有,轉載文章僅為傳播更多信息�,如作者信息標記有誤,或侵犯您的版權�,請聯(lián)系我們�,我們將在及時修改或刪除內容�,聯(lián)系郵箱:marketing@360worldcare.com