溶瘤病毒在三陰性乳腺癌臨床試驗中表現(xiàn)亮眼
三陰性乳腺癌(TNBC)約占所有乳腺癌病例的15%�,與其他類型乳腺癌相比,三陰性乳腺癌更容易擴散轉(zhuǎn)移和復發(fā),而且缺乏治療靶點�����,因此患者預后較差��,一直是乳腺癌治療的難點�����。
三陰性乳腺癌患者缺乏表達雌激素受體(ER)�����、孕激素受體(PR)����、人表皮生長因子受體-2(HER-2)這三個治療靶點�,因此缺乏治療藥物。目前���,早期三陰性乳腺癌的標準療法是化療���,以及派姆單抗����,但這些療法具有明顯副作用�����。許多研究表明���,腫瘤內(nèi)免疫細胞水平較高的患者往往對治療有更好的反應�����。這表明����,刺激免疫系統(tǒng)的藥物可能對三陰性乳腺癌患者有益�����。
溶瘤病毒(Oncolytic viruses)是一中有前途的實體瘤治療方法�����。直射到腫瘤內(nèi)后����,溶瘤病毒以癌細胞為目標,而不影響正常細胞�����,通過在癌細胞內(nèi)復制��,導致癌細胞裂解���;還能進一步引發(fā)全身免疫反應殺傷癌細胞����。
2023年2月9日����,美國莫菲特癌癥中心的研究人員在國際醫(yī)學期刊 Nature Medicine 上發(fā)表了題為:Oncolytic T-VEC virotherapy plus neoadjuvant chemotherapy in nonmetastatic triple-negative breast cancer: a phase 2 trial 的臨床研究論文。
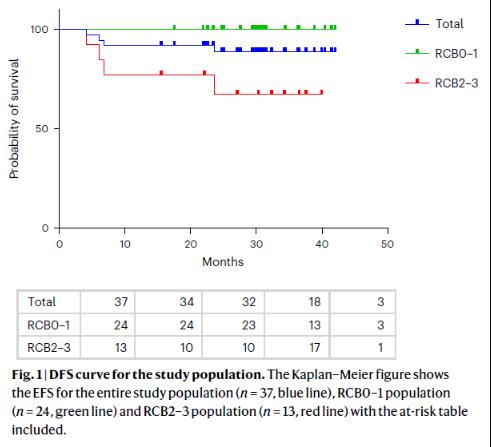
在這項2期臨床試驗中�����,37名三陰性乳腺癌患者在手術(shù)前接受T-VEC溶瘤病毒聯(lián)合化標準化療����。治療后使用殘余腫瘤負荷(RCB)來評估治療效果�����,45.9%的患者(17/37)在治療后獲得完全緩解�����,治療后兩年內(nèi)�����,89%的患者(33/37)沒有疾病復發(fā)���。
talimogene laherparepvec(T-VEC),是安進公司開發(fā)的一款基于改良的1型單純皰疹病毒(HSV-1)的溶瘤病毒療法���,該療法于2015年獲得FDA批準用于治療晚期黑色素瘤���,這也是FDA批準的一個溶瘤病毒療法。
T-VEC包含刺激免疫系統(tǒng)的GM-CSF蛋白的編碼序列��,在注射到腫瘤中后����,它可以在腫瘤細胞內(nèi)復制并表達GM-CSF蛋白�,造成腫瘤細胞裂解���,并釋放出腫瘤源性抗原和GM-CSF蛋白,加速抗腫瘤免疫應答��。
在這項臨床試驗中�,研究團隊評估了在三陰性乳腺癌患者在手術(shù)前給予T-VEC溶瘤病毒和標準化療聯(lián)合治療的效果。在這項37例三陰性乳腺癌患者參與的2期臨床試驗中�����,有45.9%的患者獲得疾病緩解�����,89%的患者在治療后兩年內(nèi)沒有復發(fā)�。除了出現(xiàn)更高水平的低燒、發(fā)冷���、頭痛和注射部位疼痛外�����,聯(lián)合療法的安全性與標準化療沒有顯著差異����。
研究團隊還分析了免疫生物標志物水平,并評估了這些生物標志物是否與患者的反應相關(guān)����。他們發(fā)現(xiàn),在治療的前6周��,大多數(shù)腫瘤樣本具有較高水平的抗腫瘤T細胞和免疫信號通路的激活���。對治療有較好反應的患者在第6周的CD8 T細胞水平高于對治療無反應的患者��。這些觀察結(jié)果表明���,早期激活免疫反應可能會導致三陰性乳腺癌患者獲得更好的結(jié)果。
該臨床試驗的領(lǐng)導者 Hatem Soliman 教授表示�,這些結(jié)果表明,T-VEC溶瘤病毒療法聯(lián)合標準化療�����,可以增加高風險�����、早期三陰性乳腺癌患者的反應。有證據(jù)表明���,腫瘤內(nèi)存在強大的免疫激活�,T-VEC結(jié)合目前的化學免疫療法治療三陰性乳腺癌是有必要的��。
聲明:本文版權(quán)歸原作者所有���,轉(zhuǎn)載文章僅為傳播更多信息,如作者信息標記有誤��,或侵犯您的版權(quán)��,請聯(lián)系我們��,我們將在及時修改或刪除內(nèi)容�,聯(lián)系郵箱:marketing@360worldcare.com