今日��,FDA宣布��,加速批準第一三共(Daiichi Sankyo)和阿斯利康(AstraZeneca)共同開發(fā),靶向HER2的抗體偶聯(lián)藥物(ADC)Enhertu(fam-trastuzumab deruxtecan-nxki�����,曾用名DS-8201)上市�����,治療無法切除或轉移性HER2陽性乳腺癌患者�����。這些患者在轉移性情況下接受過2種以上抗HER2療法的治療�����。這款備受關注的創(chuàng)新ADC提前數月沖過了FDA審評的終點線�����。這是FDA今年批準的第三款抗體偶聯(lián)藥物�����。

自從阿斯利康與第一三共在今年3月達成69億美元的研發(fā)合作����,共同開發(fā)這一潛在重磅療法以來,Enhertu就一直是業(yè)界關注的對象����。這款創(chuàng)新ADC使用了第一三共稱為DXd ADC的技術平臺,在ADC的細胞毒性藥物和連接子上作出了多種技術創(chuàng)新�����,包括:
創(chuàng)新DNA拓撲異構酶I抑制劑(DXd)具有獨特的作用機制�����,與常見化療藥物伊立替康(irinotecan)相比�����,活性提高10倍��。
具有很強滲透細胞膜的能力����,讓它們在殺傷吞入ADC的癌細胞之后,能夠殺死附近的癌細胞�����,產生“旁觀者效應”(bystander effect)。
DXd在血液中的半衰期顯著縮短��,有助于減少毒副作用的產生��。
在連接子方面����,trastuzumab deruxtecan的連接子有著非常高的穩(wěn)定性�����,讓非腫瘤組織不會受到毒性藥物的影響��。
它能夠特異性被腫瘤中高度表達的溶酶體蛋白酶切割��。
并且可以在一個抗體分子上偶聯(lián)多個細胞毒性藥物�����,提高藥物抗體比例(Drug Antibody Ratio, DAR)����。
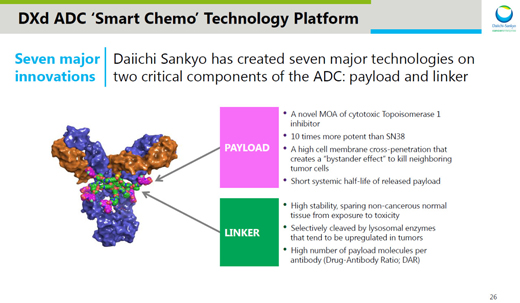
圖片來源:第一三共官網
這一批準是基于包含184名患者的關鍵性2期臨床數據。近日公布的數據表明,在治療平均接受過6種前期療法(包括ado-trastuzumab emtansine��,trastuzumab����,pertuzumab等)的HER2陽性乳腺癌患者中,Enhertu達到60.9%的客觀緩解率(ORR)和97.3%的疾病控制率(DCR)�����?���;颊叩闹形痪徑鈺r間(DOR)為14.8個月,中位無進展生存期(PFS)為16.4個月��。
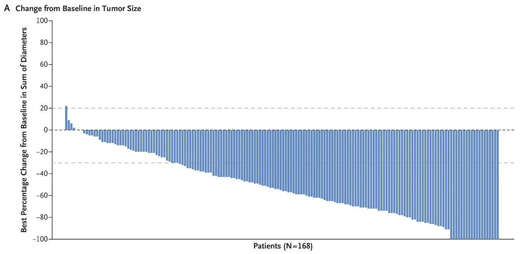
▲Enhertu顯著縮小患者腫瘤的大?���。▓D片來源:第一三共官網)
而且,Enhertu在治療HER2低表達乳腺癌患者和表達HER2的胃癌和其它癌癥類型中也表現出良好的療效��。第一三共在日前進行的研發(fā)日活動上表示��,這款創(chuàng)新ADC將是該公司近期藥物開發(fā)的重中之重��。將與阿斯利康聯(lián)合進行43項臨床試驗,不但全面覆蓋多種乳腺癌患者�����,而且涵蓋肺癌����、胃癌、結腸癌����、以及“不限癌種”適應癥患者��。阿斯利康和第一三共的雄偉目標是用它來變革HER2陽性腫瘤的治療��。
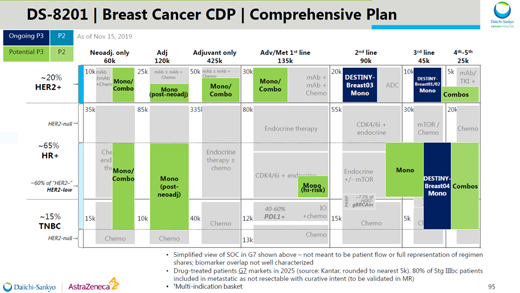

▲Enhertu在乳腺癌(上圖)和非乳腺癌(下圖)領域的臨床開發(fā)計劃(圖片來源:第一三共官網)
祝賀這款重磅ADC迅速獲批����,也期待它在今后的臨床試驗中再創(chuàng)佳績,為更多癌癥類型患者造福��。
參考資料:
[1] Enhertu label. Retrieved December 20, 2019, from https://www.accessdata.fda.gov/drugsatfda_docs/label/2019/761139s000lbl.pdf
[2] FDA approves new treatment option for patients with HER2-positive breast cancer who have progressed on available therapies. Retrieved December 20, 2019, from https://www.fda.gov/news-events/press-announcements/fda-approves-new-treatment-option-patients-her2-positive-breast-cancer-who-have-progressed-available
聲明:本文版權歸原作者所有��,轉載文章僅為傳播更多信息����,如作者信息標記有誤�����,或侵犯您的版權��,請聯(lián)系我們��,我們將在及時修改或刪除內容����,聯(lián)系郵箱:marketing@360worldcare.com




