基因編輯的肌肉干細(xì)胞應(yīng)用于臨床治療肌肉疾病的一種有前途的方法
細(xì)胞和基因療法正在成為肌肉營(yíng)養(yǎng)不良患者的現(xiàn)實(shí)選擇��。MDS是一組大約50種嚴(yán)重的、使人衰弱的單基因疾病���,導(dǎo)致一些患者逐漸無法使用肌肉進(jìn)行日常活動(dòng)��,甚至依賴呼吸支持�����。到目前為止��,治療包括支持性措施����,但糾正足夠數(shù)量的肌肉細(xì)胞的潛在遺傳缺陷將是一種治愈方法。
肌營(yíng)養(yǎng)不良大約是50種破壞性的�����、無法治療的單基因疾病���,會(huì)導(dǎo)致進(jìn)行性肌肉退化和萎縮�����。使用基于CRISPR/Cas9的工具對(duì)可移植細(xì)胞進(jìn)行基因校正是自體細(xì)胞替代療法在許多遺傳疾病中恢復(fù)器官功能的現(xiàn)實(shí)方案����。然而,到目前為止�,由于缺乏分離和繁殖肌肉干細(xì)胞的方法��,以及它們對(duì)廣泛的體外操作的敏感性����,肌肉干細(xì)胞一直處于落后狀態(tài)。
近日��,來自德國(guó)的研究者們?cè)贛olecular Therapy: Nucleic Acids雜志上發(fā)表了題為“mRNA-mediated delivery of gene editing tools to human primary muscle stem cells”的研究性文章��,該研究建立了基于CRISPR/Cas9的工具的mRNA介導(dǎo)的傳遞��,作為將基因編輯的肌肉干細(xì)胞應(yīng)用于臨床治療肌肉疾病的一種有前景的和普遍的方法���。
在本研究中��,研究人員表明�,基于mRNA的SpCas9和腺嘌呤堿基編輯程序在來自許多捐贈(zèng)者的人類肌肉干細(xì)胞中導(dǎo)致高達(dá)90%的基因組編輯效率����,無論年齡和性別�,并且不需要任何濃縮步驟�����。
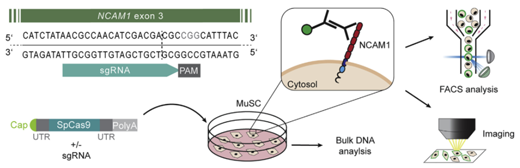
以NCAM1作為所有肌肉干細(xì)胞表達(dá)的內(nèi)源性報(bào)告基因����,其敲除不影響細(xì)胞的適合性,研究者表明�,用mRNA編輯的細(xì)胞完全保留了其肌源性標(biāo)志物的特征、增殖能力和功能屬性���。此外��,基于信使核糖核酸的堿基編輯的傳遞在單一的非選擇步驟中導(dǎo)致了導(dǎo)致肌肉營(yíng)養(yǎng)不良的SGCA突變的高效修復(fù)����。
MRNA介導(dǎo)的SpCas9基因在人MUSCs中高效敲除NCAM1
綜上所述���,該研究表明���,mRNA是一種理想的底物����,可以將基因編輯工具輸送到原代人類MUSCs���,使來自廣泛供體的細(xì)胞能夠進(jìn)行劑量依賴和整合無風(fēng)險(xiǎn)的轉(zhuǎn)基因表達(dá)和基因組編輯����,而不會(huì)影響其增殖��、成肌和分化特性���。該結(jié)果使基因編輯的人類MuSCs更接近于臨床應(yīng)用于骨骼肌疾病的移植治療。
聲明:本文版權(quán)歸原作者所有�,轉(zhuǎn)載文章僅為傳播更多信息,如作者信息標(biāo)記有誤�,或侵犯您的版權(quán),請(qǐng)聯(lián)系我們�,我們將在及時(shí)修改或刪除內(nèi)容,聯(lián)系郵箱:marketing@360worldcare.com