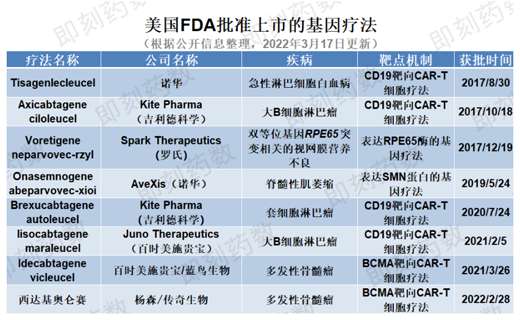
自2017年8月(Kymriah)tisagenlecleucel在美國批準用于治療急性淋巴細胞白血病以來,目前至少已有8個基因療法獲美國FDA批準上市��,其中包括近期批準的Carvykti(ciltacabtagene autoleucel),詳見下表��。
(藥明康德內容團隊制圖��,括號中公司收購了產品的研發(fā)公司)
在剛剛過去的2月份,已有楊森(Janssen)和傳奇生物聯(lián)合開發(fā)的Carvykti獲得FDA批準��,今年還有3種基因療法可能獲得FDA批準��,另外8種預計在年底前提交生物制品許可申請(BLA)。
(藥明康德內容團隊制圖)
1. 療法名稱:Betibeglogene autotemcel
公司名稱:藍鳥生物
適應癥:β地中海貧血
2022年藍鳥生物公司有兩種基因療法預計將獲得FDA批準。Betibeglogene autotemcel(beti-cel)是一種造血干細胞體外基因療法��,用于治療需要接受常規(guī)血紅細胞輸注的β地中海貧血患者��。該療法從患者體內分離出造血干細胞��,并利用病毒載體引入經過修飾��、能行使正常功能的β球蛋白基因,是一種潛在的一次性治療基因療法��。目前該BLA申請正在接受FDA審評��,PDUFA目標日期設定為2022年8月19日。藍鳥生物預計FDA外部專家委員會將在2022年6月召開會議討論這一申請��。目前該療法已獲FDA優(yōu)先審評資格,如果獲得FDA的批準��,預計該療法會成為潛在的美國一個針對β地中海貧血患者的慢病毒載體基因療法��。
2. 療法名稱:Elivaldogene autotemcel
公司:藍鳥生物
適應癥:腦腎上腺腦白質營養(yǎng)不良
FDA正在審評的藍鳥生物的第二種基因療法是elivaldogene autotemcel(eli-cel)��,治療18歲以下攜帶ABCD1基因突變的早期腦性腎上腺腦白質營養(yǎng)不良患者(CALD)��。這種疾病是由于ABCD1基因突變引起的,這種突變影響了ALD蛋白的產生��,隨后導致極長鏈脂肪酸(VLCFAs)的毒性積累,主要發(fā)生在腎上腺��、大腦與脊髓的白質中��。FDA正在審評該BLA申請,PDUFA目標日期為2022年9月16日��。與beti-cel一樣��,藍鳥生物預計FDA外部專家委員會將在2022年6月召開會議��。
3. 療法名稱:Nadofaragene firadenovec
公司名稱:FerGene(Ferring)
適應癥:膀胱癌
2022年FDA正在審查的基因療法還包括nadofaragene firadenovec(Instiladrin)��,由Ferring Pharmaceuticals的子公司FerGene開發(fā)��,用于治療對卡介苗(BCG)響應不佳的晚期高級非肌層浸潤性膀胱癌(high grade NMIBC)��。Nadofaragene firadenovec初由芬蘭基因療法公司FKD Therapies開發(fā)��,F(xiàn)erring在2018年與FKD Therapies達成合作共同開發(fā)這一基因療法��,并且將這一資產轉給了FerGene公司��。這種全新的基因療法機制可以將患者自身膀胱壁細胞轉化為制造多種干擾素的微型工廠,增強機體抵抗癌癥的天然防御能力��。2019年��,積極的3期結果顯示該療法已達到其主要療效終點��,并且具有良好的安全性和耐受性��。此前FDA曾授予其快速通道資格��,突破性療法認定和優(yōu)先審評資格,并接收遞交的BLA��。如果2022年獲得批準,該療法將為對BCG無反應的NMIBC患者提供一個有希望的選擇��。
4. 療法名稱:Beremagene geperpavec
公司:Krystal Biotech
適應癥:營養(yǎng)不良性大皰性表皮松解癥
對于即將在美國提交BLA的基因治療候選藥物��,一個介紹的是Krystal Biotech的beremagene geperpavec��,一種表達VII型膠原蛋白(COL7)的局部基因療法��,用于治療營養(yǎng)不良性大皰性表皮松解癥(DEB)��,這是一種罕見且嚴重的疾病,影響皮膚和黏膜組織��。該療法旨在通過為患者的皮膚細胞提供制造正常COL7蛋白的模板��,在分子水平上治療DEB��。繼2021年11月公布的積極安全性和有效性3期結果后��,該公司有望在2022年上半年向美國FDA提交BLA��。
5. 療法名稱:Etranacogene dezaparvovec
公司:uniQure��、CSL Behring
適應癥:血友病B
Etranacogene dezaparvovec由uniQure與CSL Behring合作開發(fā)��,旨在使用腺相關病毒5(AAV5)載體遞送表達FIX Padua變體的基因��,用于治療中重度至重度血友病B��。已在其3期試驗中證明了安全性并達到了主要和次要療效終點��。CSL計劃在2022年上半年在美國和歐盟提交該療法的上市申請��。如果獲得批準��,etranacogene dezaparvovec可能是潛在的一個為血友病B患者提供持久��、功能性治療益處的基因療法��。
6. 療法名稱:Valoctocogene roxaparvovec
公司名稱:BioMarin Pharmaceutical
適應癥:血友病A
BioMarin的基因療法候選藥物valoctocogene roxaparvovec也是一種基于AAV5的基因療法��,準備在今年提交BLA��。該療法用AAV5病毒載體遞送表達凝血因子VIII的轉基因��,用于治療血友病A��,這是一種遺傳性罕見的出血性疾病。BioMarin初于2019年12月向FDA提交了BLA,F(xiàn)DA要求提供進一步的后續(xù)數(shù)據(jù)。2022年1月��,公司公布了其全球性3期臨床試驗的兩年隨訪安全性和有效性數(shù)據(jù)��,顯示主要和次要終點均已達到��。BioMarin計劃于2022年第二季度在美國重新提交其BLA,用于治療嚴重的血友病A��,預計早獲批時間為2022年底��。
7. 療法名稱:Eladocagene exuparvovec
公司:PTC Therapeutics
適應癥:芳香族 L-氨基酸脫羧酶缺乏癥
PTC Therapeutics的eladocagene exuparvovec(PTC-AADC)是一種基因替代療法,單劑量將人類多巴脫羧酶(DDC)基因遞送到大腦的殼核中��,用于治療芳香族L-氨基酸脫羧酶缺乏癥(AADCD),一種影響大腦的罕見遺傳疾病。來自三個1期和2期臨床試驗的5年結果分析表明,AADCD兒童的運動功能和認知能力持續(xù)得到改善。公司計劃在2022年第二季度提交BLA。如果獲得批準��,這將是AADCD患者潛在的一個上市治療方式��。目前��,根據(jù)公開領域信息��,在該疾病領域尚未有其他基因療法處于后期臨床試驗中。
8. 療法名稱:Afamitresgene autoleucel
公司:Adaptimmune Therapeutics
適應癥:膜肉瘤或黏液樣/圓細胞脂肪肉瘤(MRCLS)
Afamitresgene autoleucel(afami-cel)是Adaptimmune Therapeutics公司的開發(fā)的工程化靶向MAGE-A4抗原的T細胞療法。該療法在其正在進行的滑膜肉瘤和粘液樣/圓細胞脂肪肉瘤(MRCLS)2期研究中達到了主要療效終點��。基于積極的結果,Adaptimmune準備在2022年第四季度提交一份用于滑膜肉瘤的BLA申請��。目前��,手術是滑膜肉瘤的優(yōu)選治療方法��,有些病人會在手術前后接受放射治療��。如果獲得批準��,afami-cel將為該患者群體提供具有更高生活質量的替代治療��。
9. 療法名稱:CTX001
公司名稱:CRISPR Therapeutics��、Vertex Pharmaceuticals
適應癥:β地中海貧血��;鐮刀型細胞貧血病
CTX001是一種非病毒載體的基因編輯療法��,由CRISPR Therapeutics和Vertex合作開發(fā)��,用于治療患有輸血依賴性β地中海貧血(TDT)或嚴重鐮刀型細胞貧血?�。⊿CD)的患者��,通過在體外對患者的造血干細胞進行改造��,使紅細胞中產生高水平的胎兒血紅蛋白(HbF)��。該療法已完成其正在進行的3期研究的患者注冊��,并已對70多名患者進行了給藥��。CTX001已獲得美國FDA授予治療TDT和SCD的再生醫(yī)學先進療法(RMAT)認定��、以及快速通道和孤兒藥資格。Vertex計劃在2022年底提交CTX001用于治療這兩種適應癥的全球(包括美國FDA)監(jiān)管申請文件��。
10. 療法名稱:EB-101
公司:Abeona Therapeutics
適應癥:隱性營養(yǎng)不良型大皰性表皮松解癥
今年有望在美國遞交上市申請的另外一種COL7A1基因靶向療法是Abeona的EB-101��。該療法是一種體外基因校正的自體細胞療法��,將COL7A1膠原蛋白基因插入到患者自身的皮膚細胞(角質形成細胞)中��。該療法正在一項3期安全性和有效性臨床試驗中進行研究��,用于治療隱性營養(yǎng)不良型大皰性表皮松解癥(RDEB)��,這是一種罕見的結締組織疾病��,目前還沒有獲得批準的療法��。在1/2期研究中��,EB-101已顯示出可觀的傷口愈合和長達六年的長期疼痛減輕效果��。Abeona已完成其3期試驗的患者注冊��,并預計將在2022年第三季度提供一線結果��,隨后將在2022年底或2023年初提交BLA申請��。
11. 療法名稱:OTL-103
公司名稱:Orchard Therapeutics
適應癥:Wiskott-Aldrich綜合征
Orchard Therapeutics的OTL-103是一種自體造血干細胞基因療法��,包括用編碼Wiskott-Aldrich綜合征(WAS)基因的慢病毒載體體外轉染的CD34+細胞,旨在通過單次注射治療Wiskott-Aldrich綜合征��,這是一種罕見的遺傳性免疫缺陷紊亂。該療法已獲得FDA授予的孤兒藥資格和罕見兒科疾?�。≧PD)資格。目前,評估療效和安全性的3期臨床試驗正在進行中��,Orchard計劃在2022年初與FDA討論其潛在的BLA申請��。
聲明:本文版權歸原作者所有��,轉載文章僅為傳播更多信息��,如作者信息標記有誤��,或侵犯您的版權��,請聯(lián)系我們��,我們將在及時修改或刪除內容��,聯(lián)系郵箱:marketing@360worldcare.com