基因編輯已經(jīng)開始應用于基礎理論研究和生產(chǎn)應用中����,這些研究和應用��,有助于推進生命科學許多領(lǐng)域的發(fā)展�,從研究植物和動物的基因功能到人類的基因治療�。
本文中,小編整理了2020年科學家們在基因編輯研究領(lǐng)域的重要研究進展����,分享給大家!
【1】CRISPR兩大“宗師”合作����,揭示單堿基編輯器3D結(jié)構(gòu),解析脫靶機制基因編輯領(lǐng)域兩位“宗師”David Liu及Jennifer A. Doudna合作��,首次揭開了一種“有前途”的堿基編輯器的3D結(jié)構(gòu)�,為調(diào)整堿基編輯器,使之在應用過程中更加靈活和可控提供了一個參考�����。早期的腺嘌呤堿基編輯器(ABE)效率都很低�。然而,新的ABE8e卻快到令人驚訝���,對DNA的脫氨基速率比ABE7.10和miniABEmax分別高出590倍和1170倍�����。然而�,這也意味著,ABE8e可能更容易造成脫靶效應����。對此,研究人員利用冷凍電子顯微鏡(Cryo-EM)成像技術(shù)�,解析了ABE8e結(jié)合DNA時的3D結(jié)構(gòu)?�;钚詸z測表明����, ABE8e之所以容易產(chǎn)生更多的脫靶編輯,是因為與Cas9融合的脫氨酶蛋白始終處于活躍狀態(tài)�。由于這項研究首次報告了這種融合蛋白的結(jié)構(gòu),它可能有助于指導無數(shù)其他基于Cas9的基因編輯工具的設計����。該研究于7月31日發(fā)表在《科學》雜志上。
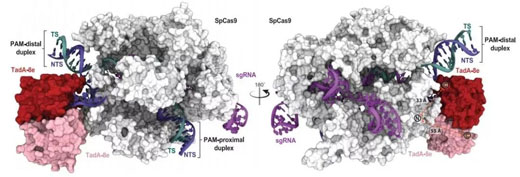
ABE8e捕獲DNA時的Cryo-EM結(jié)構(gòu)
DOI:10.1126/science.abb1390
【2】David Liu再獲新突破:無需實驗,就能知道基因編輯結(jié)果David R. Liu團隊在哺乳動物細胞中38,538個基因組整合靶標上表征了11個胞嘧啶和腺嘌呤堿基編輯器(CBE和ABE)的序列-活性關(guān)系����,并使用所得結(jié)果訓練了BE-Hive機器學習模型,可準確預測堿基編輯基因型結(jié)果(R ≈0.9)和效率(R≈0.7)����。研究人員以≥90%的準確度糾正了3388個與疾病相關(guān)的單核苷酸變異(SNV),其中包括675個等位基因�����,其“旁觀者”核苷酸被BE-Hive正確預測�,因此無法編輯�����。該研究發(fā)現(xiàn)了先前無法預測的C-to-G或C-to-A編輯的決定因素��,并利用這些發(fā)現(xiàn)以≥90%的準確性糾正了174個病原性SNV編碼序列����。利用BE-Hive設計新的CBE變體,以調(diào)節(jié)編輯結(jié)果����。這些發(fā)現(xiàn)啟發(fā)了堿基編輯����,實現(xiàn)了以前難以處理的目標的編輯���,并為新的基礎編輯器提供了改進的編輯功能�。該研究于7月23日發(fā)表在《Cell》雜志�。
DOI:https://doi.org/10.1016/j.cell.2020.05.037【3】迄今小基因編輯工具,體積僅為CRISPR-Cas9的一半����!
加州大學伯克利分校創(chuàng)新基因組學研究所的研究人員發(fā)現(xiàn)了一種新型基因編輯工具——CasΦ,一種小的CRISPR-Cas系統(tǒng)�����,由1?70 KD的CasΦ蛋白和一個CRISPR陣列組成�,且僅在巨大噬菌體的基因組中編碼,其體積是CRISPR-Cas 9的一半����。研究人員發(fā)現(xiàn)CasΦ在其天然環(huán)境中是一種功能性噬菌體蛋白和真正的CRISPR-Cas效應子,能夠裂解crRNA互補的DNA�。此外�����,這種單RNA系統(tǒng)比其他活性CRISPR-Cas系統(tǒng)緊湊得多�。其中�����,具有單個指導RNA的CasΦ-2能夠編輯多達33%的細胞��,這與先前報道的CRISPR-Cas9�����,CRISPR-Cas12a和CRISPR-CasX的水平相當��。這項研究于7月17日發(fā)表在《科學》雜志上�����。
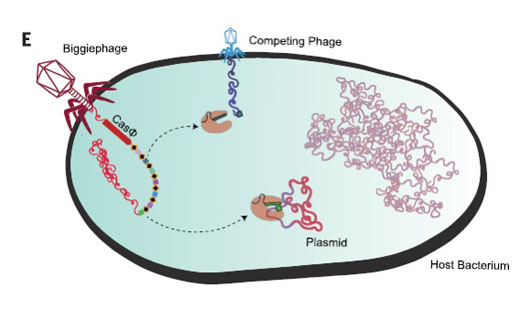
巨噬細胞編碼的CasΦ在其宿主的超感染情況下的功能示意圖
DOI: 10.1126/science.abb1400
【4】葉海峰團隊開發(fā)出遠紅光激活的基因編輯系統(tǒng)華東師大葉海峰團隊開發(fā)出了遠紅光(730 nm)激活的Split-Cas9(FAST)系統(tǒng)�,該系統(tǒng)可無創(chuàng)地誘導動物組織內(nèi)部深處的細胞中的基因編輯活性���。FAST系統(tǒng)依賴于兩個具有高親和力結(jié)合域的分裂Cas9融合蛋白:Cas9的一半是組成性表達的�,而另一半由該研究團隊先前建立的細菌光敏色素BphS光學控制系統(tǒng)的FRL誘導控制。研究人員在人類胚胎腎(HEK)-293細胞中放置了FAST系統(tǒng)組件���,并使用基于發(fā)光二極管(LED)的遠紅光(FRL)照射來證明靶向基因組編輯的成功激活��。之后�����,在不同的人類細胞系中實現(xiàn)了FRL誘導編輯后���,研究人員通過植入物實驗,證實FAST能夠在位于動物皮下組織的細胞中強有力地激活基因編輯���。然后�,他們在轉(zhuǎn)基因tdTOMATO報告小鼠系的實驗中�,建立了FRL誘導的小鼠體細胞(肝細胞)的快速介導編輯,以及在異種移植瘤小鼠中對癌細胞進行細胞周期失活基因編輯的研究��,以此證明了FAST能夠?qū)辜膊?。這項研究于7月17日發(fā)表在《科學進展》雜志上。
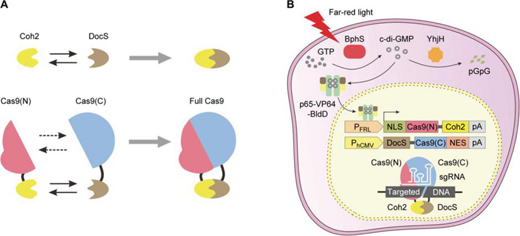
FAST系統(tǒng)的設計
DOI: 10.1126/sciadv.abb1777
【5】劉如謙團隊再作創(chuàng)舉�����!首次開發(fā)線粒體基因編輯工具!
繼“單堿基編輯法”和“先導編輯”這兩大基因編輯技術(shù)突破后����,全球基因編輯領(lǐng)域的前列學者,麻省理工學院和哈佛大學布羅德研究所的化學生物學家劉如謙(David R. Liu)團隊發(fā)現(xiàn)�,一種細菌毒素,DddA��,可以將胞嘧啶(C)轉(zhuǎn)化為尿嘧啶(U)�。DddA可直接作用于雙鏈DNA,無需依靠Cas9酶來進行破壞�����。該研究使用一個不依賴CRISPER堿基編輯器——DdCBE���,實現(xiàn)了對線粒體基因組的精準編輯,這是優(yōu)異的研究和治療線粒體遺傳病的工具���。除了試圖創(chuàng)建人類線粒體疾病的細胞和小鼠模型外���,研究人員還將尋找其他可以修飾雙鏈DNA的細菌脫氨酶。他們還希望提高編輯效率并減少脫靶編輯���,以便可以在人類中測試mtDNA基礎編輯�。該研究于7月8日發(fā)表在《自然》雜志。
DOI:10.1038/s41586-020-2477-4
【6】CRISPR編輯iPSC新進展:首次報告協(xié)同基因編輯效應日本京都大學iPS細胞研究所的科學家新研究表明(Nature Communications����,2020),DNA DSB修復與細胞周期之間有協(xié)同作用���,有利于ssOND介導的單核苷酸基因編輯�����。在iPS細胞中建立了基于GFP到BFP轉(zhuǎn)化的熒光DNA修復測定方法����,可視化定量單等位基因和雙等位基因靶向過程中DNA修復結(jié)果的頻率����。研究發(fā)現(xiàn),通過特定培養(yǎng)條件和小分子調(diào)節(jié)DNA修復和細胞周期�����,可協(xié)同增強同源性定向修復(HDR)的頻率�。但是���,高頻HDR編輯主要導致雙等位基因報告基因系統(tǒng)中純合突變體的產(chǎn)生,為了在這些條件下生產(chǎn)雜合突變體��,這個團隊采用了使用混合ssODN修復模板的策略���,來保護具有沉默突變的一個等位基因���。在內(nèi)源性常染色體位點應用此協(xié)同基因編輯策略,與基線HDR水平相比����,精準編輯生成的雜合和純合突變提高了幾倍。該研究于6月8日發(fā)表于《自然通訊》雜志���。
DOI:10.1038/s41467-020-16643-5
【7】李大力團隊開發(fā)新型雙堿基基因編輯器
盡管堿基編輯器是用于精準基因組編輯的有用工具����,但是當前的堿基編輯器只能轉(zhuǎn)換腺嘌呤或胞嘧啶����。華東師范大學李大力團隊通過將兩個脫氨基酶與一個Cas9切口酶融合來開發(fā)腺嘌呤和胞嘧啶雙堿基編輯器(A&C-BEmax)��,以在同一目標位點實現(xiàn)C-to-T和A-to-G轉(zhuǎn)換。與單堿基編輯器相比��,A&C-BEmax對腺嘌呤的活性略有降低���,而對胞嘧啶的活性較高�����,RNA脫靶活性大大降低���。這項研究成果于6月1日發(fā)表在《自然生物技術(shù)》雜志。
DOI:10.1038/s41587-020-0527-y
【8】擺脫PAM限制�,基因編輯工具再升級
哈佛醫(yī)學院和麻省總醫(yī)院的Benjamin P. Kleinstiver實驗室再度對SpCas9蛋白進行了強勢升級,改造后的SpCas9突變體SpRY幾乎完全擺脫了PAM困擾��,其識別的PAM序列涵蓋NRN和NYN(Y為C/T)(NRN > NYN)����。SpRY和以此為基礎構(gòu)建的單堿基編輯系統(tǒng)在PAM為NRN的位點處展現(xiàn)出強大的編輯能力,而在PAM為NYN的位點處的編輯能力雖然有所降低����,但依然可觀。該研究開發(fā)的SpCas9突變體SpRY是當前對PAM序列兼容性較高的SpCas9突變體���,幾乎完全擺脫了PAM序列的限制�,其在基因組范圍內(nèi)的編輯能力得到了極大的提高,而衍生而來的單堿基編輯系統(tǒng)讓精準編輯幾乎拓展至全基因組范圍���。這項研究成果于3月27日發(fā)表在《科學》雜志上�。
DOI: 10.1126/science.aba8853
針對基因編輯領(lǐng)域的研究不勝枚舉���,以上僅羅列了其中的一小部分��。在基因編輯技術(shù)取得一個又一個突破后����,又因其技術(shù)上的潛在風險而飽受爭議��。未來基因編輯技術(shù)又該何去何從����?我們能否合理的利用這把“上帝賜予的手術(shù)刀”?這是一個值得思考的問題�。但在未來,科學家將對基因編輯的機制進行深入的剖析�,相信有朝一日,科學家能夠利用基因編輯技術(shù)克服疾病,造福人類健康�。
聲明:本文版權(quán)歸原作者所有�,轉(zhuǎn)載文章僅為傳播更多信息,如作者信息標記有誤�,或侵犯您的版權(quán),請聯(lián)系我們�,我們將在及時修改或刪除內(nèi)容,聯(lián)系郵箱:marketing@360worldcare.com


